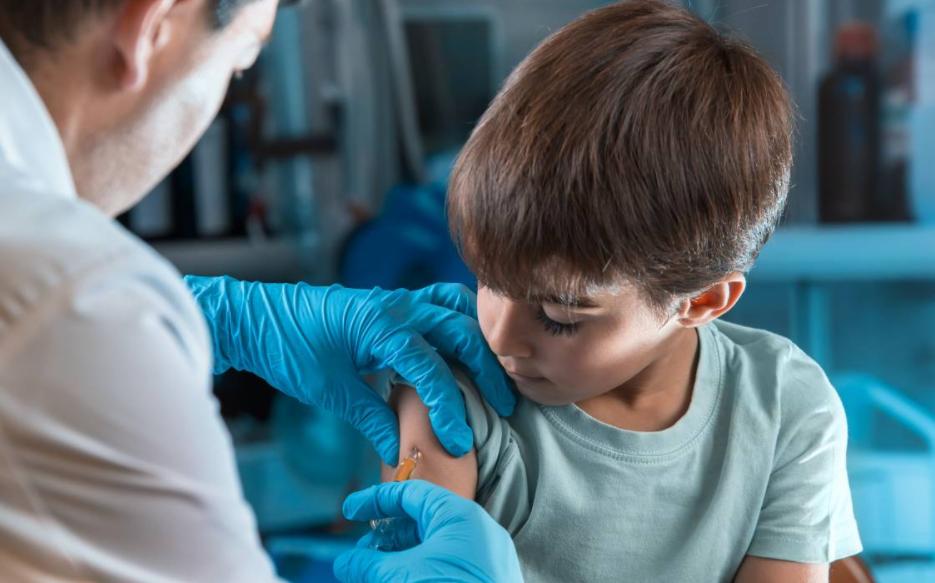
La esperada vacunación en los niños es el siguiente gran paso que están dando algunos países para completar la inmunización de sus poblaciones. En ese sentido, los laboratorios Pfizer y Moderna están llevando adelante ensayos clínicos en niños de entre 5 y 11 años y esperan que antes de fin de año hayan concluido las pruebas y se presenten las solicitudes de autorización de emergencia a la Administración de Alimentos y Medicinas (FDA, por sus siglas en inglés).
Un funcionario de la FDA ha confirmado a la prensa estadounidense que la autorización de uso para menores de 12 años podría ocurrir apenas un par de semanas después de que los laboratorios presenten la solicitud de la vacuna para menores.
La agencia además informó que el plan es que una vez que la vacuna esté aprobada para los menores de edad de manera de emergencia (tal como ha ocurrido con los adultos), esperan trabajar más rápido de lo habitual en una aprobación total. Al parecer, a través de varias encuestas realizadas por la agencia, han determinado que varios padres expresan preocupación con colocar en sus niños una vacuna que no tiene aprobación final.
Hasta el momento, ninguna vacuna contra el COVID-19 ha recibido aprobación total, sino que es una aprobación de emergencia para uso en mayores de 12 años. Pfizer es el único laboratorio que hasta ahora ha solicitado aprobación total de la vacuna para mayores de 18, algo que según la FDA pudiera pasar en cuestión de días.
Pfizer-BioNTech y Moderna comenzaron sus estudio clínicos en niños en marzo. Según los cálculos, para el otoño boreal deberían haber culminado. Al tratarse de menores de edad, los protocolos son más rigurosos.
Las autoridades sanitarias de los Estados Unidos exigen a las farmacéuticas que entreguen datos de por lo menos cuatro meses de monitoreo en menores de edad, indicando que idealmente deberían ser seis meses. En el caso de vacunas para adultos, de manera experimental, alcanza con datos recolectados durante solo dos meses.